多禧生物全媒体中心 报道
2022年3月3日,国家药品监督管理局药品审评中心(CDE)受理了多禧生物1类生物制品DXC004A的临床申请(受理号:CXSL2200111)。该款药物申报的适应症为晚期实体瘤。
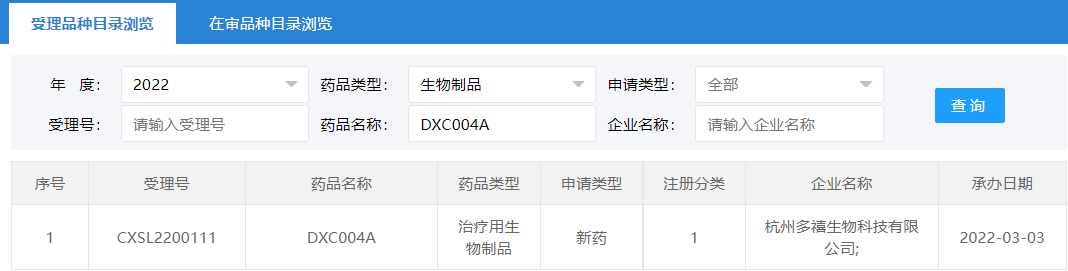
申报获批
(采集自CDE官网)
截至目前,多禧生物已经有5款药物成功申报IND,此前4款药物分别是:
靶向HER-2的DX126-262(注射用重组人源化抗Her2单抗-Tub114偶联剂)。目前该款药物正在进行II期临床试验,适应症为乳腺癌/胃癌/尿路上皮癌/非小细胞肺癌。
靶向Trop-2的DAC-002(注射用重组人源化抗Trop2单抗-Tub196偶联剂),适应症为Trop-2阳性的晚期实体瘤。该款药物在亚洲地区(除日韩外)的开发与商业化已与君实生物合作(君实代号 JS108)目前正在进行I期临床试验。
靶向Muc-1的DAC-005(注射用重组人源化抗Muc1单抗-Tub201偶联剂),适应症为Muc-1阳性的晚期实体瘤。
DXC007于去年12月28日获批临床,适应症为复发/难治急性髓系白血病(AML)等血液肿瘤。
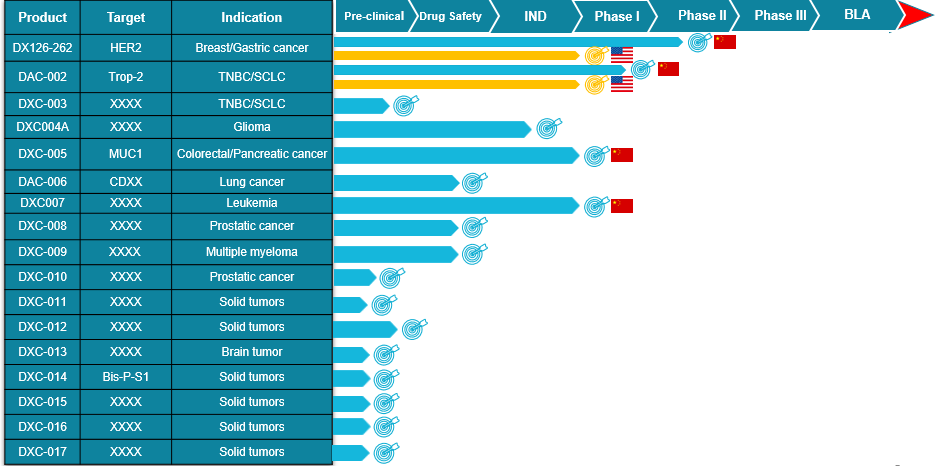
公司产品管线图
(多禧生物全媒体中心制作)
多禧生物成立于2012年12月31日,经过9年的研发积累与沉淀,多禧生物已经进入了收获期,拥有处于不同阶段的17款ADC药物。随着更多的ADC药物进入临床、实现商业化,我们希望能给癌症病人,尤其是晚期病人提供新的治疗手段,实现“让原创药禧济天下”的美好愿景。